CRISPR基因編輯治療的展望
黃中洋
彥臣生技藥品股份有限公司
摘要
基因編輯技術CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats) 為科學家編輯基因提供了一種前所未有的精確度。它不僅可以用於微生物、植物與動物,還可以用於人類。CRISPR 基因編輯的精確性使其能夠對基因進行以前其它技術無法實現的切割。這種精確度不僅對醫學的未來,而且對人類作為一個物種的未來都產生了巨大的影響。CRISPR 對治癒與 DNA 相關的多種疾病有的巨大的潛力。本文簡單介紹CRISPR 基因編輯、其在治療疾病上的應用、與未來的展望。
關鍵字: CRISPR、基因編輯、 Cas9、嚮導RNA、鐮狀細胞病貧血、脫靶
壹、前言
CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats) Technology (常間回文重複序列叢集技術) 是一種簡單快速編輯DNA技術的名稱。這技術的發明被認為是生物與醫學界的革命性突破,因為它讓基因體中某一特定位置的基因可以簡單而且便宜地被移除、增加、或替換。該技術簡單說明是這樣的:首先在細胞中找到特定的一段DNA 序列,然後利用CRISPR技術去剪掉或更改那段DNA,藉以改變基因的功能。換句說,無論是人類、其他動物、或是植物、甚至是微生物的細胞基因,都可經由這技術迅速而精確地被改變。
貳、CRISPR技術如何用來編輯基因
一、CRISPR序列是細菌受病毒攻擊後留存的記憶
CRISPR是原核細胞如細菌或古菌之基因體中的一群DNA序列,當原核生物被曾感染它們的噬菌體(病毒)再度感染時,CRISPR被用來檢測以及破壞病毒的DNA,是原核生物抵禦入侵病毒的一種保護機制1,CRISPR群由短DNA重複序列 (repeats) 與間格序列 (spacers) 組成。當病毒入侵時,細菌為了保護自己,會切割並破壞入侵病毒的DNA;在病毒感染後倖存下來時,會將一部份病毒的DNA儲存在重複序列之間成為新的間格DNA序列,好比將認識病毒的記憶片段儲存在資料庫內,以備在下次再受相同病毒感染時可以辨識。當同一病毒再度入侵時,細菌的CRISPR防禦系統就會切斷與間格DNA序列匹配的任何病毒DNA,殺死病毒,使細菌不受傷害。
二、CRISPR如何運作
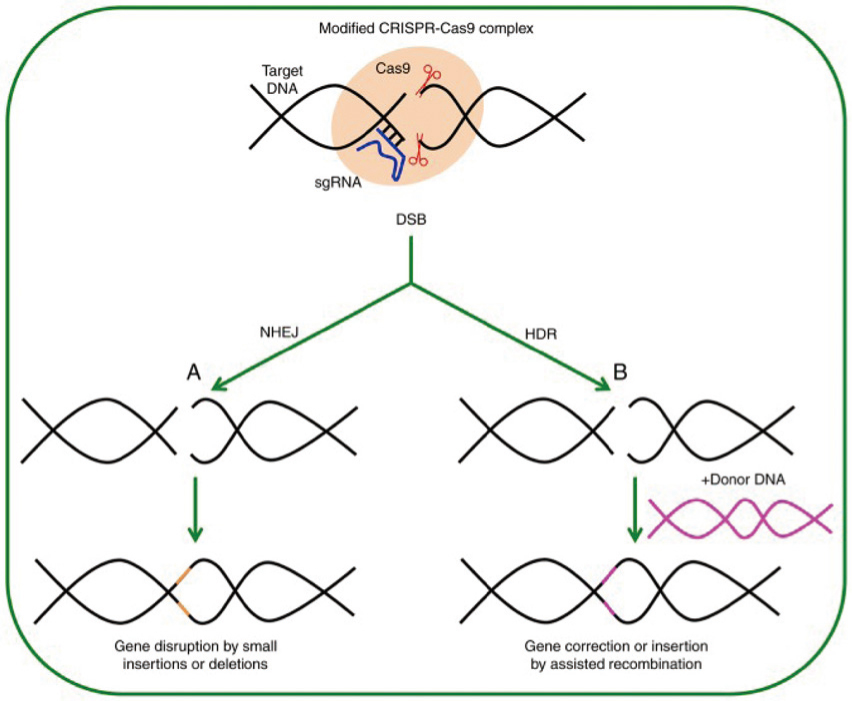
CRISPR防禦系統需要一稱為「CRISPR關聯蛋白質9」(CRISPR associated protein 9,Cas9) 的內核酸酶 (endonuclease),作為切斷DNA的“剪刀”,另需借助一可辨識特定片段DNA的可編程的嚮導RNA (programmable RNA guide)。嚮導RNA是與特定對象基因例如製造鐮狀細胞的基因互補的單鏈。 Cas9 酶利用嚮導RNA沿著DNA鏈˙“讀取”宿主的DNA,好像在地圖上找地點一樣地找尋目標基因。當匹配基因找到時,酶的內部機制觸發,進行切割工作,通常會切割核苷酸中的鍵。切割後,細胞自身修復DNA的機制將通過使用稱為「非同源末端連接」(non-homologous end joining,NHEJ) 的方式,將DNA重新接合在一起。以上的步驟稱為“基因敲除(gene-knock-out,KO)”。這過程速度很快,但通常會出差錯或無法完美修復,導致細胞無法再讀取和轉譯基因而失活。科學家也可以利用細胞的自然DNA的修復途徑來編輯或插入新的遺傳密碼,稱為“基因敲入(gene-knock-in,KI)”。其過程是這樣的:將CRISPR/Cas9酶與DNA模組同時置入細胞,把新基因插入精確的位置。這過程需要第二種 DNA 修復機制,即「同源定向修復」(homology directed repair,HDR),它比非同源末端連接更精確,但需要更長的時間。圖一為CRISPR運作的簡單圖解說明2。
圖一 CRISPR/Cas9系統進行基因組編輯2
說明:Cas9 和 嚮導RNA (gRNA) 形成一個複合物,與靠近 PAM 位置的 DNA 結合,在目標位址作雙鏈切割 (DSB),隨後的修復可以經由NHEJ或 HDR 進行。 (A) NHEJ 的修復通常的結果是插入或剔除DNA,或框移 (frameshits) 敲除基因,阻擾原基因功能。 (B) 如果提供的 DNA (donor DNA) 末端具有同源性,該 DNA 則可以插入目標位點以修飾基因,將核苷酸引入,形成框移或插入互補DNA ( cDNA),而修改或提供基因新功能。
名詞說明:sgRNA:single guide RNA,單嚮導RNA分子;PAM:protospacer adjacent motif,原始間隔基相鄰基序,為協助Cas酶辨識切點的短DNA序列,鄰位於切點3-4個核苷酸的下游 (downstream);DSB:double strand break,雙鏈切割;NHEJ:non-homologous end joining,非同源性末端接合;HDR:homology directed repair,同源修復;frameshits:框移,指DNA分子經嵌入或缺失一個或多個鹼基;cDNA:complement DNA,互補DNA,通常是以RNA為模板複製的DNA。
科學家Jennifer Doudna 和 Emmanuelle Charpentier將這種細菌的CRISPR-Cas9系統改造成一種可編輯動物、植物和人類DNA的工具3。這兩位科學家隨後的研究更進一步指出:在動植物中使用細菌RNA引導的CRISPR-Cas9系統的簡便基因組工程,正在改變生物學。從最初發現到闡明CRISPR-Cas9系統的作用機制後,基因體編輯 (genome editing) 技術已經為所有三個生命域:古菌、細菌與真核生物 (3 domains:Archaea, Bacteria and Eukaryote) 的各種細胞和生物體的修改、調節或標記基因組位點的發展,奠定了堅強的基礎;基因組操作不再是阻礙實驗的瓶頸,在生物技術的所有分項中都可應用到,包括人類治療疾病的方法4。2020年,兩位科學家因這方面的研究成果獲得了諾貝爾獎。
參、基因編輯在治療疾病的應用
2017年CRISPR被用於基因治療得到突破性的成果:美國波特蘭俄勒岡健康與科學大學 (Oregon Health & Science University in Portland) 的科學家們使用CRISPR成功地去除了胚胎中的心臟病缺陷,顯示出這項技術有巨大潛力!它不僅可以治療而且可以預防許多疾病:
一、治療罕見基因缺陷疾病
基因編輯細胞治療的人體試驗首先用於治療兩種罕見的遺傳性血液疾病:輸血依賴性β-地中海貧血 (transfusion-dependent β-thalassemia , TDT) 和鐮狀細胞病 (sickle cell disease,SCD) 貧血。這兩種疾病是嚴重且可能危及生命的單基因疾病。BCL11A 是一種轉錄因子蛋白質,它可抑制紅血球細胞中γ-球蛋白和胎兒血紅蛋白的表達,而引起貧血。兩名分別患有TDT與SCD的患者,在清髓 (myeloablation) 後,接受了用CRISPR-Cas9系統編輯BCL11A基因後之自體 CD34+ 細胞治療。一年多後,這兩名患者的骨髓和血液中有高的等位基因編輯(allelic editing) 水平,胎兒血紅蛋白的增加廣泛分佈於細胞中,病人不再需要依賴輸血來生存,SCD患者中的血管閉塞的發作也消除了5。2021年6月美國生技公司CRISPR Therapeutics公告已經有22名TDT與SCD病人接受其CRISPR-Cas9基因編輯治療,這些病人在治療後,追蹤了三個月以上,全數展現出持續性與一致性的效果。2021年6月底美國另一家生技公司Intellia Therapeutics更公告具有里程碑意義的臨床試驗,該臨床試驗的試驗物質不是用細胞,而是直接用CRISPR-Cas9 基因編輯的複合組成物。「轉甲狀腺素蛋白澱粉樣變性」(transthyretin amyloidosis或稱為ATTR amyloidosis) 的病人經過這種組成物注射治療後,血清中「甲狀腺素運載蛋白」(TTR) 濃度明顯降低6。ATTR amyloidosis的特徵是TTR因錯誤折疊,在組織中逐漸累積,尤其是在心臟與神經組織中累積,而造成病變,是一種會危及生命的疾病。以上這兩件成果分別刊登於著名醫學期刊New England Journal of Medicine上。這些治療成效令人興奮,為根治罕見基因缺陷疾病帶來了厚望。除了血液疾病外,CRISPR技術亦用來治療萊伯氏先天性黑蒙症 (Leber congenital amaurosis)、囊腫性纖維化 (cystic fibrosis)、裘馨氏肌肉失養症 (Duchenne muscular dystrophy)、亨丁頓舞蹈症(Huntington's disease)等基因缺陷的罕見疾病。
二、治療非罕見基因缺陷疾病
近年來基因編輯治療更推展到普通的疾病,進展最多的在癌症,例如用基因編輯將病人細胞中編碼PD-1蛋白質的基因剔除以治療肺癌7、用CRISPR技術做成的CAR-T細胞治療血癌等8。在愛滋病治療方面,CRISPR技術有兩個層面可以運用,一是將藥物無法控制之潛伏病毒的DNA切斷,一是修改宿主免疫細胞表面CCR5 接受體的基因編碼,使病毒無法經由CCR5 接受體進入宿主免疫細胞9。而在心血管疾病方面基因編輯被用於治療肥厚性心肌症 ( hypertrophic cardiomyopathy ) 10 與經由編改PCSK9基因降低低密度脂蛋白等11。
肆、基因編輯治療的挑戰
一、脫靶 (Off-target) 的風險
基因編輯存在著出差錯的風險。編輯系統可能切斷目標區外與目標區序列相似的DNA。在這種情況下,可能會修改到目標基因以外的基因或調控區域,從而導致不良的下游效應,發生不希望出現的插入、剔除和染色體易位。不需要的改變也可能發生在正確靶位 (on-target)上,即對目標的基因組區域進行意外的修改;如此,目標基因內的調控元件就可能會被無意中改變。
CRISPR-Cas9 系統本質上就容易出現脫靶效應,因為 CRISPR-Cas9 中的靶位點的識別僅依賴短片段的 RNA-DNA 的相互作用,而 RNA-DNA 相互作用有配對錯誤的機會12。近幾年來基因編輯系統更進步了,錯誤的機會降低了!因為編輯技術已進步到能只編輯DNA的單一鹼基,鹼基編輯不需要切斷雙鏈DNA來修改鹼基對 (base pair),因此基因組發生較大改變(例如染色體易位)的機會就大大降低了。
二、醫學倫理問題
使用 CRISPR-Cas9 等技術進行基因組編輯來改變人類基因組時,出現了倫理上的問題。本來基因組編輯僅限於體細胞,即卵子和精子以外的細胞。這些變化只影響某些組織,不會代代相傳。然而,對卵子或精子(生殖細胞)或胚胎基因的改變,可能會傳遞給後代。生殖細胞和胚胎基因組編輯帶來了許多倫理的挑戰,例如使用這項技術來增強正常的人類特徵(例如身高或智力),即設計嬰兒 (designer baby) 或優化人種 (eugenics) 是否妥當,或者是否應被允許,這牽涉到科學、宗教、人倫、社會、與政府等問題,有待討論與決定。目前基於對倫理和安全的考量,生殖細胞和胚胎基因組編輯在許多國家是非法的。2018年11月,中國生物學家賀建奎宣稱:有一對經過他作基因編輯後的雙胞胎姊妹誕生。這對姊妹的父親是愛滋病帶原者,兩姊妹出生後均未感染到愛滋病。賀建奎和他的團隊利用 CRISPR 技術,修改人類受精卵的CCR5基因,目的是讓胚胎在發育過程中對愛滋病毒免疫。賀建奎和他的團隊的行為受到科學界的嚴重批評,也被中國法院判處監獄刑責與罰款。
伍、結論
2012年CRISPR問世至今,短短約十年時間,激起了類似海嘯般的研究浪潮,幾乎每經過一段短時間,就有新的突破性研究發表出來。利用 CRISPR,研究人員可以進行幾年前還無法想像的基因實驗,不僅可以針對遺傳性疾病,還可以針對其它促成常見疾病如愛滋病、癌症和心臟病的基因進行研究。除了治療疾病以外CRISPR-Cas9基因組編輯技術亦可應用於藥物作用機制的探索、尋找抗藥性基因、開發免疫療法與篩選新的藥物靶點等。由目前已取得的巨大進展看來,CRISPR/Cas9在治療疾病的實現中,具有無窮的潛力!
The Prospect of CRISPR Technology in The Treatment of Human Disease
Chung-Yang Huang
Nature Wise Biotech & Medicals Corporation
Abstract
CRISPR technology allows scientists to edit genomes with a kind of precision never seen before. Not only can it be used on microorganisms, plants and animals, but it can also be used on human beings. The precision of CRISPR allows it to make cuts in the gene that had previously been impossible by other technologies. This precision carries enormous repercussions not just for the future of medicine but also for the future of humanity as a species. CRISPR has tremendous potential to cure a wide range of diseases linked to DNA. This article briefly introduces CRISPR gene editing and its application and ramifications in the treatment of diseases.
參考資料:
1. Barrangou R, Fremaux C, Deveau H, et al. CRISPR provides acquired resistance against viruses in prokaryotes. Science 2007; 315, 1709–1712.
2. Rodríguez-Rodríguez DR, Ramírez-Solís R, Garza-Elizondo MA, et al. Genome editing: A perspective on the application of CRISPR/Cas9 to study human diseases (Review). Int J Mol Med. 2019 Apr; 43(4): 1559–1574.
3. Jinek M, Doudna JA, Charpentier E, et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 2012 Aug 17; 337(6096):816-21.
4. Doudna JA, Charpentier E. Genome editing: The new frontier of genome engineering with CRISPR-Cas9. Science. 2014 Nov 28; 346(6213):1258096.
5. Frangoul H, Altshuler D, Cappellini MD , et al. CRISPR-Cas9 Gene Editing for Sickle Cell Disease and β-Thalassemia. N Engl J Med 2021 Jan 21; 384(3):252-260.
6. Gillmore JD, Gane E, Taubel J, et al. CRISPR-Cas9 In Vivo Gene Editing for Transthyretin Amyloidosis. N Engl J Med. 2021 Jun 26.doi: 10.1056/NEJMoa2107454
7. Qian Liu. World-First Phase I Clinical Trial for CRISPR-Cas9 PD-1-Edited T-Cells in Advanced Nonsmall Cell Lung Cancer. Glob Med Genet. 2020 Oct; 7(3): 73–74.
8. Chun I, Kim K, Chiang Y, et al. CRISPR-Cas9 Knock out of CD5 Enhances the Anti-Tumor Activity of Chimeric Antigen Receptor T Cells. 62nd American Society of Hematology Annual Meeting and Exposition 2020 Dec 7, Oral Presentation 554.
9. Xun J, Zhang X, Guo S, et.al. Editing out HIV: application of gene editing technology to achieve functional cure. Retrovirology. 2021; 18 (39)
10. German DM, Mitalipov S, Mishra A, et al. Therapeutic Genome Editing in Cardiovascular Diseases. JACC Basic Transl Sci. 2019 Feb; 4(1): 122–131.
11. Musunuru K, Chadwick AC, Kathiresan, S. In vivo CRISPR base editing of PCSK9 durably lowers cholesterol in primates. Nature 2021, 593: 429–434.
12. Ernst MPT, Broeders M, Herrero-Hernandez P, et al. Ready for Repair? Gene Editing Enters the Clinic for the Treatment of Human Disease. Mol Ther Methods Clin Dev. 2020 Sep 11; 18: 532–557.
通訊作者:黃中洋/通訊地址:台北市八德路三3號6樓 彥臣生技藥品股份有限公司
服務單位:彥臣生技藥品股份有限公司/聯絡電話:(O) 02-25706300 ext 101