阿茲海默症新藥Aducanumab之介紹
林姝芸、林慧娟
嘉義基督教醫院藥劑科
摘要
阿茲海默症(Alzheimer's disease, AD)是一種腦部認知功能退化的疾病,包括語言表達、空間認知、心智記憶等都會逐步衰退,甚至失去生活自理能力,必須完全依賴他人照顧,對於家庭或是社會都是無形的負擔。本篇將介紹2021年6月由美國FDA核准的阿茲海默症新藥,aducanumab為人體單株抗體(monoclonal antibody),選擇性跟β型澱粉樣蛋白寡聚物(amyloid-β oligomers)、β型澱粉樣蛋白原纖維(amyloid-β fibrils)結合,降低腦中β型澱粉樣蛋白斑塊(amyloid-β plaques)沉積,進而改善患者認知功能的惡化,相較以往的藥物只能延緩疾病進展和減緩症狀,期望aducanumab能有效根治阿茲海默症。
關鍵字: Alzheimer's disease、aducanumab、amyloid-β oligomers、amyloid-β fibrils、amyloid-β plaques
壹、 前言
阿茲海默症(Alzheimer's disease, AD)自1906年發現起,至今已成為全球流行的神經退化性疾病之一,臨床症狀為記憶和認知的功能性損害,到了疾病的末期,患者已無法和他人進行正常的溝通,也無法再回到以前的生活環境。到2020年為止,在美國65歲以上患有阿茲海默症患者超過580萬人,到了2060年,估計會超過1400萬人,阿茲海默症在美國的前十大死因排名第六名,65歲以上老人死因排名第五名1。在各類型的失智症(dementia)中,因阿茲海默症而引起的類型約50-60%,根據國際失智症協會(Alzheimer's disease International)2019年全球失智症報告,估計全球有超過5千萬名患者2。在台灣109年底的流行病學調查結果,65歲以上失智症有291,961人,推估台灣失智症共303,271人,佔全國總人口1.29 %,代表在台灣約每77人中便有1人是失智症患者2。
現今,在臨床上治療阿茲海默症的藥品有兩種,乙醯膽鹼酯解酶抑制劑(acetylcholinesterase inhibitor)和NMDA受體拮抗劑(N-methyl-D-aspartate receptor antagonist),但兩者藥物都只能減緩症狀和延緩病情的進展,並不能達到直接治療的效果。在2021年6月,aducanumab核准上市,是繼2003年以來,20年後通過治療阿茲海默症的藥物。
貳、 藥理機轉
過度的β型澱粉樣蛋白(amyloid-β)沉積在人體腦部時,會引起tau蛋白過度磷酸化、神經纖維糾結(neurofibrillary tangles, NFTs)、突觸細胞失去功能、神經元死亡和認知功能受損4。aducanumab為人體免疫球蛋白G1(immunoglobulin gamma 1, IgG1)單株抗體,可以直接跟可溶性的β型澱粉樣蛋白寡聚物(amyloid-β oligomers)和不可溶性的β型澱粉樣蛋白原纖維(amyloid-β fibrils)結合,來抑制其聚集形成斑塊(plaques)沉澱3,4。從臨床試驗的結果顯示,aducanumab降低β型澱粉樣蛋白斑塊沉澱的能力,和其劑量高低以及治療時間長短具有相關性3。
參、 適應症和用法劑量3
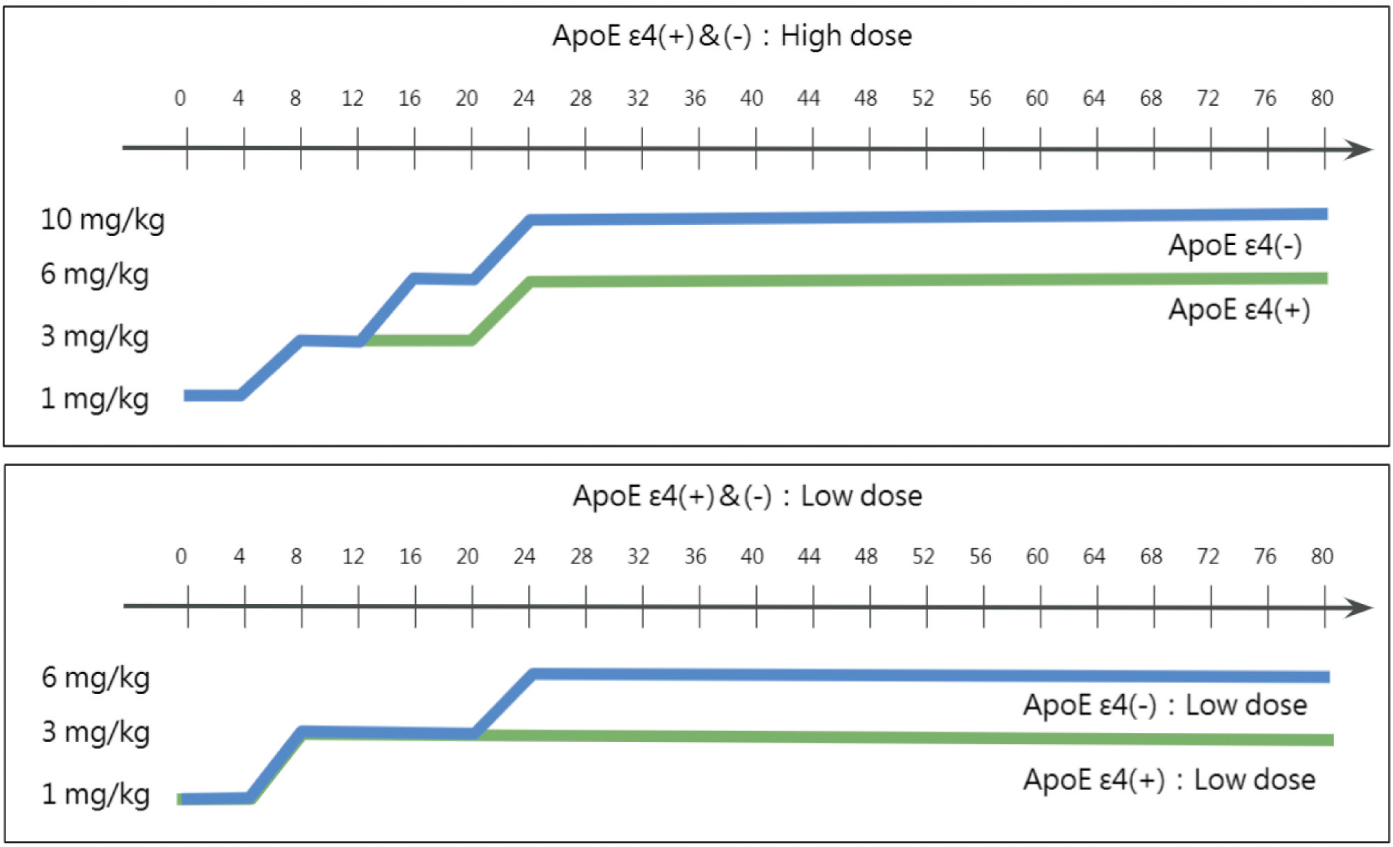
用於治療已確診有β型澱粉樣蛋白斑塊的初期阿茲海默症患者,透過減少β型澱粉樣蛋白斑塊的沉澱,來減緩阿茲海默症患者的認知功能退化。aducanumab給藥方式為靜脈注射,靜脈輸注時間至少需1小時,四個禮拜給一次劑量,兩個劑量之間至少間隔21天。aducanumab的初始劑量為1mg/kg,劑量調整方式如下:第1和2劑為1mg/kg、第3和4劑為3mg/kg、第5和6劑為6mg/kg,第7劑之後開始給10mg/kg。
肆、 臨床試驗結果3,5
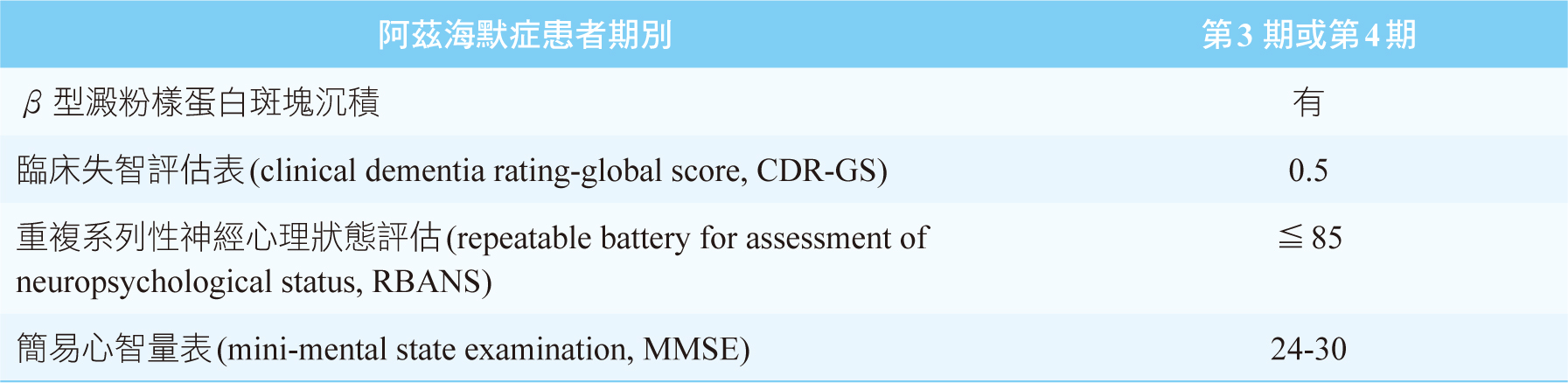
根據EMERGE、ENGAGE第三期臨床試驗結果,美國FDA核准aducanumab用於有β型澱粉樣蛋白沉積的阿茲海默症患者。此兩項第三期臨床試驗設計皆屬於雙盲、隨機、安慰劑對照組、平行設計,在加拿大、美國、英國、日本、台灣等20個國家招募受試者,收錄的患者條件如表一,總共收錄3285人,以1:1:1的比例隨機分配,分別給予低劑量aducanumab、高劑量aducanumab和安慰劑,為期18個月,評估有效性和安全性。
表一 EMERGE和ENGAGE試驗中收錄患者條件
Aducanumab的第三期臨床試驗EMERGE和ENGAGE方法相同,評估主要終點為在第78週臨床失智評估表各項總分(clinical dementia rating-sum of boxes, CDR-SB)分數變化百分比;次族群結果分析為,透過正子電腦斷層攝影(positron emission tomography, PET)來看患者腦部β型澱粉樣蛋白斑塊下降的幅度(standardized uptake value ratio, SUVR)。在早期的臨床試驗中發現6,具有E型載脂蛋白APOE ε4(apolipoprotein E gene對偶ε4基因)的患者在高劑量aducanumab給予時,容易發生澱粉樣蛋白相關影像異常相關的腦水腫(amyloid-related imaging abnormalities edema, ARIA-E),因此在第三期臨床試驗中,患者分為有無APOE ε4基因,而有APOE ε4基因的組別其劑量會較低(圖一)。
圖一 EMERGE和ENGAGE試驗中之給藥療程5
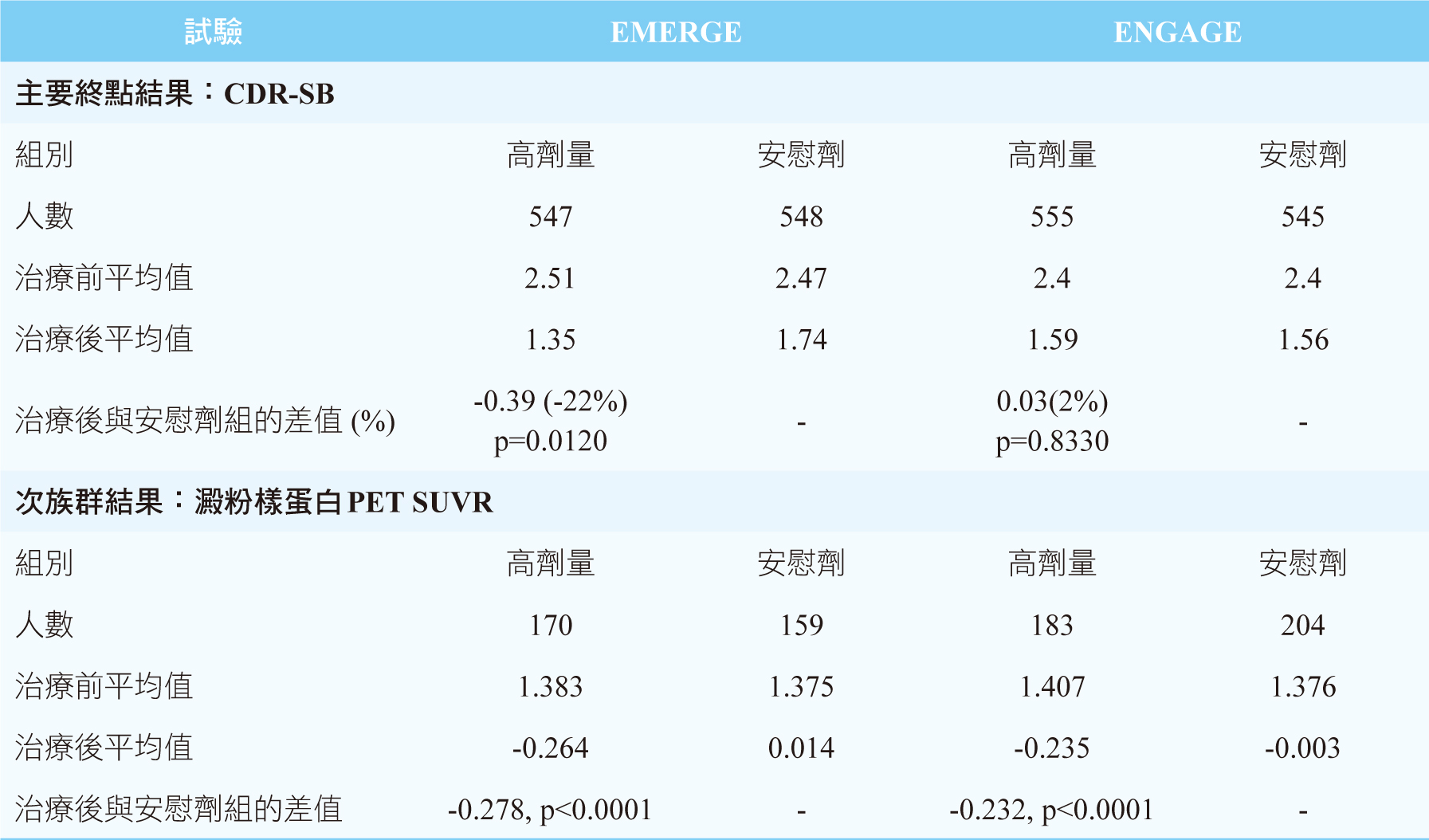
EMERGE試驗中,納入1638例患者,其中547例接受高劑量aducanumab、543例接受低劑量aducanumab、548例接受安慰劑,主要終點中和安慰組比較顯示,高劑量組平均CDR-SB下降22%( p = 0.0120),低劑量組平均CDR-SB下降15%( p = 0.0901)。ENGAGE試驗中,納入1647例患者,其中555例接受高劑量aducanumab、547例接受低劑量aducanumab、545例接受安慰劑,主要終點中和安慰組比較顯示,高劑量組平均CDR-SB上升2%( p = 0.8330),低劑量組平均CDR-SB下降12%( p = 0.2250)。次族群結果澱粉樣蛋白PET SUVR分析,aducanumab能顯著降低患者腦中β型澱粉樣蛋白斑塊,其效果隨著治療時間拉長和劑量增加有相關性,EMERGE和ENGAGE試驗中的高劑量組別和安慰劑比較,澱粉樣蛋白PET SUVR皆顯著下降0.278%(p<0.0001)和0.232% (p<0.0001)。在主要終點中兩者試驗的高劑量組,雖然得到不同的結果,EMERGE試驗中CDR-SB下降代表患者認知障礙症狀緩解,而ENGAGE試驗中CDR-SB卻沒有顯著差異,但在次族群結果兩個試驗的高劑量組均能顯著降低β型澱粉樣蛋白斑塊(表二)。
表二 EMERGE和ENGAGE試驗中結果3,5
有些臨床研究顯示7,8,會對人體腦部造成神經傷害和惡化阿茲海默症的關鍵物質,並非不可溶的β型澱粉樣蛋白斑塊,而是可溶性的β型澱粉樣蛋白寡聚體,也指出β型澱粉樣蛋白斑塊下降和臨床症狀的改善缺乏相關性研究,再加上aducanumab不是完全選擇性結合β型澱粉樣蛋白寡聚體,因此推論可能是持續給予高劑量的aducanumab,降低β型澱粉樣蛋白寡聚體來達到臨床上改善認知功能的效果。藉由以上臨床研究的假說,便可以解釋為什麼EMERGE和ENGAGE試驗中次族群結果是正向結果,但主要終點結果卻是不同。
伍、 安全性和副作用4,5
在安全性評估,EMERGE和ENGAGE試驗中,高劑量組別皆有相對較高的不良反應發生率,常見的不良反應包括(>10%)澱粉樣蛋白相關影像異常相關的腦水腫(35%)和腦出血(19%)、頭痛(21%)、跌倒(15%)。在高劑量組中導致終止治療的不良反應發生率為5%,而其中最常見的原因為澱粉樣蛋白相關影像異常相關的腦水腫或腦出血,可以透過頭部核磁共振做追蹤和診斷,因此建議患者在開始給予aducanumab治療前,應有1年內的頭部核磁共振的檢查結果,接下來給予第一劑高劑量aducanumab 10mg/kg前和第六劑10mg/kg前,都應再做一次頭部核磁共振檢查,避免出現無症狀的澱粉樣蛋白相關影像異常副作用。澱粉樣蛋白相關影像異常副作用的症狀包括頭痛、意識混亂、瞻望、暈眩、視覺模糊等,當病人出現這些症狀時,應馬上接受檢查來評估其嚴重程度,之後再決定是否繼續療程、增加劑量或維持目前劑量。
有APOE ε4基因的患者,發生澱粉樣蛋白相關影像異常相關的腦水腫發生率比沒有APOE ε4基因的患者高,分別為42%和20%,症狀通常發生在治療早期階段(給藥的前八劑),此症狀會隨著時間而緩解,約68%患者在治療第12週、91%患者在治療第20週症狀得到改善。
陸、 特殊族群3
一、 孕婦和哺乳
目前沒有足夠的數據來評估孕婦和哺乳的安全性,但考慮到可能會有藥物相關的不良反應,包括對孕婦和胎兒造成的風險,因此不建議孕婦和哺乳期間使用。
二、 老年族群
EMERGE和ENGAGE試驗收錄的患者,年紀範圍落在50-85歲,平均年齡為70歲,其中79%為65歲以上、32%為75歲以上,根據兩者試驗結果,在不同年齡層的不良反應發生率並無差別。
柒、 總結
過去20年來,全球一直致力於開發新機轉、能根本治療阿茲海默症的藥物,但過去許多早期臨床試驗結果都是失敗,直到今年6月,FDA通過新藥aducanumab審核上市,才帶給阿茲海默症患者治療的新希望。EMERGE和ENGAGE試驗的主要終點結果雖然不一樣,但在次群族結果上,高劑量的aducanumab能明顯降低β型澱粉樣蛋白斑塊。因此在FDA審核通過新藥aducanumab的聲明敘述9,期望透過降低腦中β型澱粉樣蛋白斑塊沉澱,來預防阿茲海默症患者的認知和其他臨床症狀的惡化,也希望aducanumab上市後,能蒐集更多臨床數據以及觀察更長的時間,完成上市後的第四期臨床試驗報告,來驗證aducanumab能達到預期中的治療效果。
New Treatment for Alzheimer's Disease-Aducanumab
Shu-Yun Lin, Hui-Chuan Lin
Department of Pharmacy, Ditmanson Medical
Foundation Chia-Yi Christian Hospital
Abstract
Alzheimer's disease is a neurodegenerative disorder and the most common type of dementia. This progressive disease begins with mild memory loss, impairments in cognitive function, behavioral disturbances and these symptoms may lead to patients loss of ability to solve problems or response to the environment. This article introduces the novel therapy, aducanumab, which is approved by the U.S.A FDA at June 2021. Aducanumab is human monoclonal antibody that selective reacts with amyloid-β oligomers and fibrils. The clinical trials for aducanumab show that a reduction in amyloid-β plaques and it is expected to have clinical benefits to patients.
參考資料:
1. Centers for Disease Control and Prevention: Alzheimer's Disease. (accessed at http://www.cdc.gov/aging/aginginfo/alzheimers.htm)
2. 社團法人台灣失智症協會 (accessed at http://www.tada2002.org.tw/About/IsntDementia)
3. Aducanumab藥品仿單
4. Francesco Panza, Madia Lozupone, Giancarlo Logroscino, et al. A critical appraisal of amyloid-β-targeting therapies for Alzheimer disease. Nat Rev Neurol. 2019 Feb;15(2):73-88.
5. EMERGE and ENGAGE Topline Results: Two Phase 3 Studies to Evaluate Aducanumab in Patients With Early Alzheimer's Disease (https://investors.biogen.com/static-files/ddd45672-9c7e-4c99-8a06-3b557697c06f). 2019.
6. David S. Knopman, David T. Jones, Michael D. Greicius. Failure to demonstrate efficacy of aducanumab: An analysis of the EMERGE and ENGAGE trials as reported by Biogen December 2019. Alzheimers Dement. 2021 Apr;17(4):696-701.
7. Martin Tolar, Susan Abushakra, John A. Hey, et al. Aducanumab, gantenerumab, BAN2401, and ALZ-801—the first wave of amyloid targeting drugs for Alzheimer's disease with potential for near term approval. Alzheimers Res Ther. 2020 Aug 12;12(1):95.
8. Martin Tolar, Susan Abushakra, Marwan Sabbagh. The path forward in Alzheimer's disease therapeutics: Reevaluating the amyloid cascade hypothesis. Alzheimers Dement. 2020 Nov;16(11):1553-1560.
9. FDA's Decision to Approve New Treatment for Alzheimer's Disease. (accessed at https://www.fda.gov/drugs/news-events-human-drugs/fdas-decision-approve-new-treatment-alzheimers-disease)
通訊作者:林姝芸/通訊地址:嘉義市東區文雅街150巷9號10樓之一
服務單位:戴德森醫療財團法人嘉義基督教醫院藥劑科/聯絡電話:(O) 05-2765041轉5101