胃腸道基質瘤的新型藥物
巫櫻桃1、吳俊男1、李建瑩2
1中山醫學大學附設醫院藥劑科、2中山醫學大學藥理學科
摘要
胃腸道基質瘤(gastrointestinal stromal tumour, GIST)是消化道最常見的間葉性腫瘤 (mesenchymal neoplasms)。GIST約占所有腸胃道惡性腫瘤的1-3%。主要發病的中位年齡為60-65歲的成年人,男女分佈比例相等。GIST是由腸胃壁的卡哈氏間質細胞 (interstitial cells of Cajal, ICC) 或其幹細胞所長出來。好發部位常見於胃部(60-70 %)和小腸(20-30 %)。針對非轉移性局部的GIST,手術是治療首選,目標是要將腫瘤完整切除。對於轉移性或不可切除的 GIST的治療是標靶藥物治療。目前常用的標靶藥物是酪氨酸激酶抑制劑(tyrosine kinase inhibitors, TKIs),第一線藥物為imatinib (基利克, Glivec),第二、三線藥物則為sunitinib (紓癌特, Sutent)及regorafenib(癌瑞格, Stivarga)。最近,美國食品藥物管理局(FDA)批准了兩種新的酪氨酸激酶抑制劑用於治療PDGFRα外顯子18基因突變或晚期/不可切除的GIST患者,包括avapritinib和ripretinib。本文將對這兩種新藥物進行簡要回顧,進一步了解這兩種藥物的有效性和安全性數據。
關鍵字: Gastrointestinal stromal tumor、GIST、avapritinib、ripretinib、tyrosine kinase inhibitors
壹、前言
胃腸道基質瘤(gastrointestinal stromal tumour, GIST)是消化道最常見的間葉性腫瘤 (mesenchymal neoplasms)。GIST是由腸胃壁的卡哈氏間質細胞 (interstitial cells of Cajal, ICC) 或其幹細胞所長出來1。發生率約為每百萬人6.8-15例2。主要發病的中位年齡為60-65歲的成年人,男女分佈比例相等3。GIST約占所有腸胃道惡性腫瘤的1-3%。好發部位常見於胃部(60-70%)和小腸(20-30%)1,但也可能發生在胃腸道的任何部位(大腸、食道、網膜、腸繫膜、直腸)。60-70%的GIST發生在胃部。最常見的臨床表現是胃腸道出血。其他症狀包括腹痛不適,有時會有急性腹痛(acute abdominal pain) 1。GIST的發生主要是歸因於幹細胞因子接受器(KIT)和血小板衍生生長因子接受器(platelet-derived growth factor receptor alpha, PDGFRα)的酪氨酸激酶(tyrosine kinase)突變。其中KIT佔了69-83%,而PDGFRα佔了5-10%2。也有一些並沒有發生酪氨酸激酶的突變,稱為野生型(wild type),大約占15%左右。而KIT的突變大部分發生在外顯子11 (exon 11)約67%,其次是外顯子9 (exon 9)約10%)1。PDGFRα的突變則大多發生在外顯子18(exon 18)約占6%。其中D842V突變占exon 18突變的60-70%1。
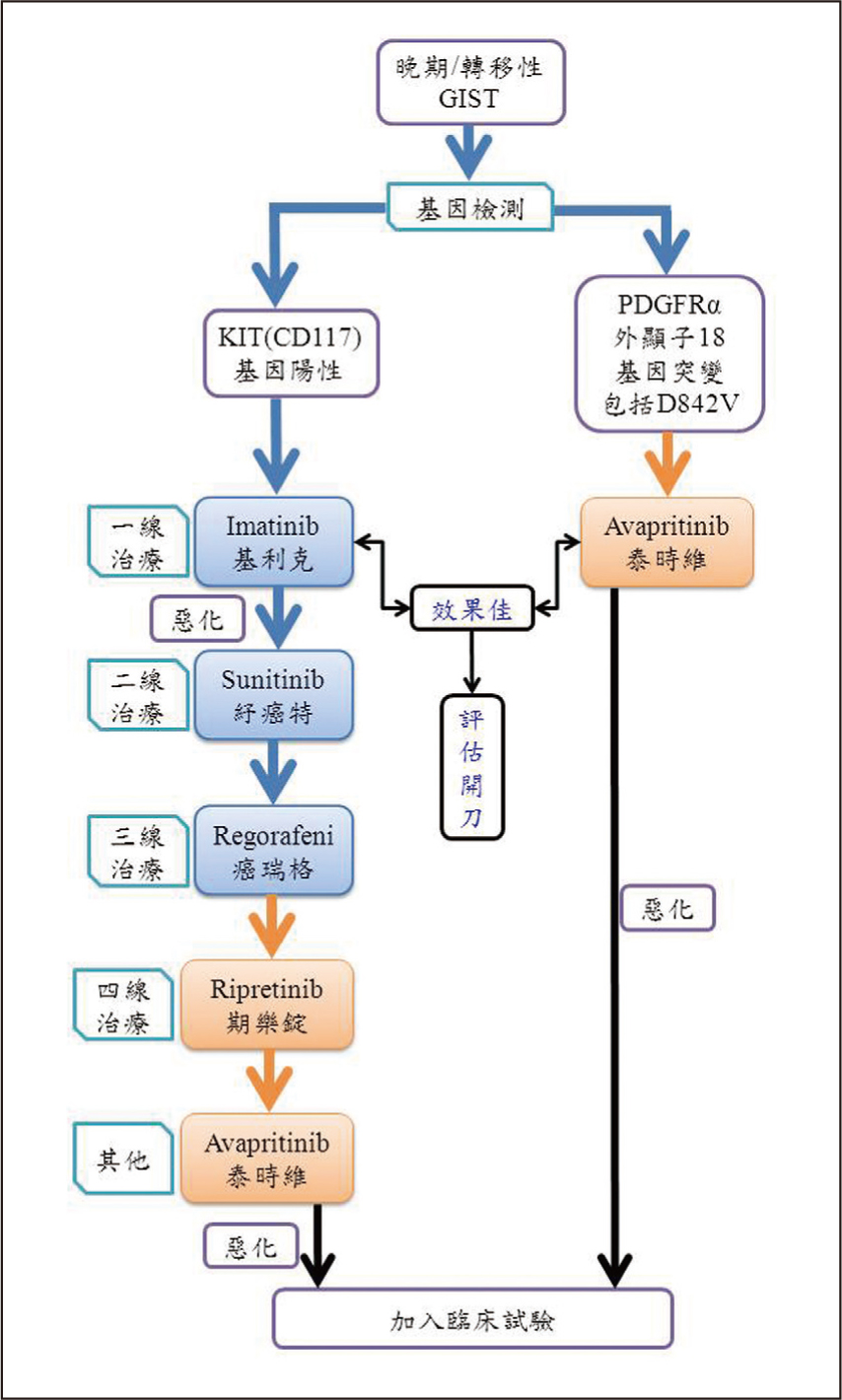
GIST使用傳統化學治療及放射線療的效果不佳。手術切除和標靶藥物治療是目前最重要的治療方式3。針對非轉移性GIST,手術是治療首選1,3,目標是要將腫瘤完整切除。手術方式包括傳統開腹手術、微創腹腔鏡手術和達文西機械手臂。目前常用的標靶藥物是酪氨酸激酶抑制劑(tyrosine kinase inhibitors, TKIs)(表一),第一線藥物為imatinib (基利克, Glivec),第二、三線藥物則為sunitinib (紓癌特, Sutent)及regorafenib(癌瑞格, Stivarga)。但對於PDGFRα外顯子18突變型患者(包括D842V突變)或使用到第三線藥物仍然無療效的晚期GIST患者,過去並無效果較佳的藥物可以使用。最近,美國食品藥物管理局(FDA)批准了兩種新的酪氨酸激酶抑制劑用於治療晚期/不可切除的GIST患者,包括avapritinib(高選擇性抑制劑,用於PDGFRα外顯子18基因突變,包括D842V突變)和ripretinib(廣譜激酶c-Kit和PDGFRα抑制劑) (圖一)3。在這篇綜述中,我們將討論avapritinib和ripretinib的安全性和有效性。
表一 治療胃腸道間質瘤的標靶藥物
圖一 晚期/轉移性GIST治療準則3
貳、Avapritinib ( Ayvakit)4
Avapritinib是一種口服的小分子藥物,對PDGFRα與KIT活化環基因突變具有高效力及高選擇性的抑制劑。Avapritinib是第一個被核准用於GIST的精準療法。
一、適應症、用法和劑量、藥物動力學4-7
FDA於2020/1/9核准用於治療PDGFRα外顯子18突變(包括D842V突變)的不可手術切除或轉移性GIST成人患者。而D842V突變是最常見的PDGFRα外顯子18突變。在2021/3/25也取得我國衛生福利部藥證,中文品名:泰時維膜衣錠,適應症是治療具有血小板衍生生長因子α受體(PDGFRA)D842V突變,無法切除或轉移性腸胃道間質瘤的成年病人。建議劑量為300mg,每日空腹口服一次,持續接受治療直到疾病惡化或出現無法耐受的毒性。
Avapritinib口服後達到最高血中濃度時間(Tmax)約2-4.1小時。每天一次 300 mg後,最高血中濃度(peak plasma concentration, Cmax)為813 ng/mL。而在每天30-400mg劑量範圍內,觀察到avapritinib最高血中濃度和曲線下面積(Area Under the Curve, AUC)與劑量成比例增加。與空腹狀態相比,在高熱量、高脂肪飲食後服用avapritinib,會使avapritinib的Cmax增加59%,因此,應空腹服用(至少飯前1小時或飯後2小時)。Avapritinib的血漿蛋白結合率為98.8%,平均總分佈體積(volume of distribution, Vd)是1200公升。Avapritinib主要透過 CYP3A4代謝,少部分經由CYP2C9代謝。排泄半衰期是32-57小時,口服清除率(oral clearance, CL/F)約為19.5L/hr。
二、臨床研究及安全性
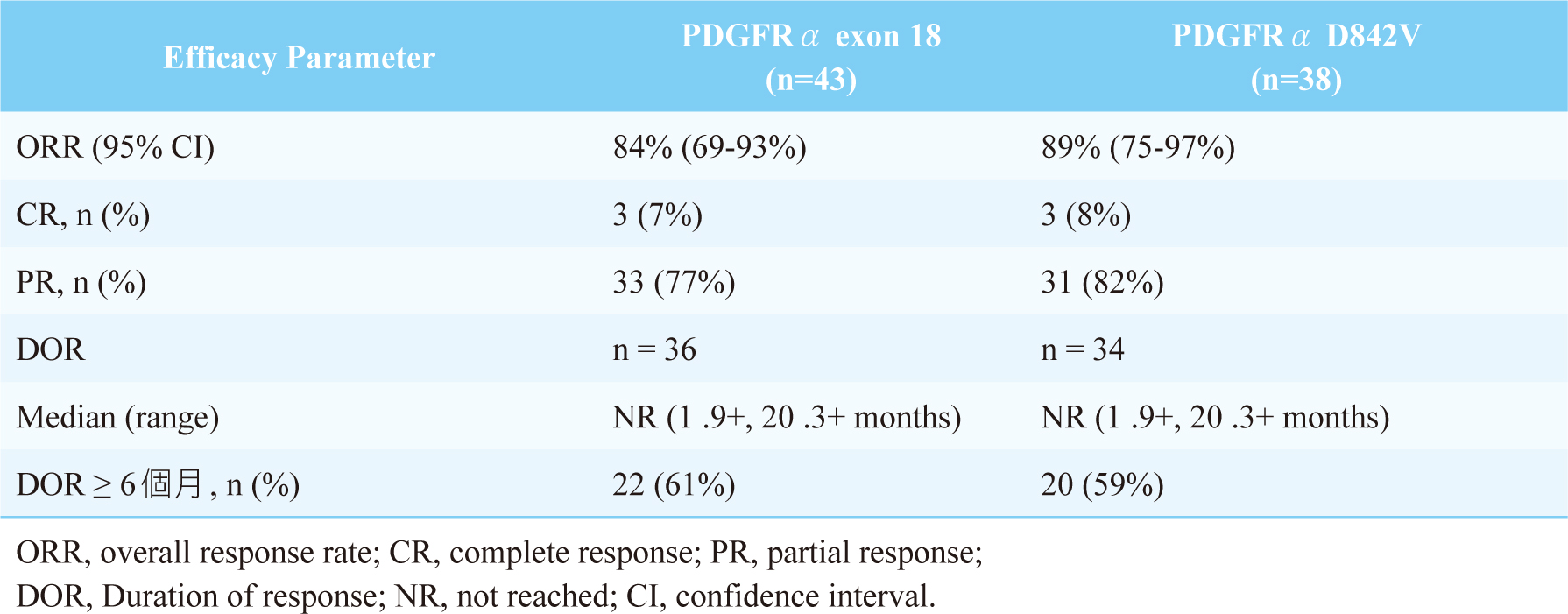
NAVIGATOR (NCT02508532)試驗屬多中心、開放性的臨床試驗。旨在評估avapritinib的安全性、耐受性和抗腫瘤活性(assess the safety, tolerability, and antitumour activity of avapritinib)。收納條件為GIST確診患者且經美國東岸癌症臨床研究合作組織(Eastern Cooperative Oncology Group, ECOG)日常體能狀態(performance status, PS)評分為0-2分,口服avapritinib 300或400 mg,每日一次。共收納43名攜帶 PDGFRα外顯子18突變GIST患者,其中包括38名患有PDGFRα D842V突變的患者。研究結果顯示(表二)6,7:對於具有PDGFRα外顯子18突變患者,腫瘤客觀緩解率(Objective Response Rate, ORR)為84% (95% CI, 69至93),其中7%完全緩解(Complete Response, CR),77%部分緩解(Partial Response, PR)。中位緩解持續時間(Duration of response, DOR)尚未達到,61%的患者DOR ≥ 6個月。對於PDGFRα D842V突變患者,整體緩解率為89% (95% CI, 75至97),其中完全緩解為8%,部分緩解為82%。
表二 Avapritinib的臨床試驗結果
三、不良反應與注意事項5,6
有關安全性方面,avapritinib在臨床試驗上常見的不良反應(發生率≥20%)有:水腫(72%)、疲倦/虛弱(61%)、噁心(64%)、嘔吐(38%)、腹瀉(37%)、腹痛(31%)、便祕(23%)、認知障礙(48%)、頭暈(22%)、食慾下降(38%)、皮疹(23%)。如發生不良反應後,建議調整avapritinib劑量。第一次調降為200mg,每日口服一次。第二次調降為100mg,每日口服一次。Avapritinib主要透過CYP3A4代謝,因此,應避免同時使用強或中度CYP3A抑製劑或誘導劑。如果不能避免與中度CYP3A4抑製劑共用,建議減少avapritinib的起始劑量為口服100mg,每日一次。孕婦或哺乳期婦女不建議使用。
參、Ripretinib (Qinlock)8
Ripretinib是首個被批准用於GIST的第四線標靶藥物(Fourth-Line),是一種的新型的酪氨酸激酶開關控制抑制劑(a switch-control tyrosine kinase inhibitor),具有雙重作用機制,來抑制激酶開關和活化環相互作用,導致這些激酶無法從非活性構象轉變為活性構象,從而廣泛有效抑制KIT和PDGFRα基因突變導致的激酶活化。
一、適應症、用法和劑量、藥物動力學5,8,9
FDA於2020/5/15核准用於治療先前已接受過imatinib,sunitinib和regorafenib治療的晚期GIST成人患者。在2021/7/26也取得我國衛生福利部藥證,中文品名:期樂錠。適應症是適用於治療已接受3種或以上激酶抑制劑(包括imatinib)治療的晚期胃腸道基質瘤(GIST)成人病人。建議劑量為每天一次口服150mg,持續接受治療直到病況惡化或出現無法耐受的毒性。空腹或飯後服用皆可,不受食物影響。
Ripretinib在進入人體後,會代謝成具有活性的DP-5439,DP-5439也具有相同的廣泛抑制突變活性。口服ripretinib後,達到最高血中濃度時間(Tmax)約4小時,DP-5439則是15.6小時。Ripretinib和DP-5439的血漿蛋白結合率分別為99.8%和99.7%。單次口服regorafenib 150mg後,平均總分佈體積(volume of distribution, Vd)是307公升,而DP-5439是507公升。Ripretinib和DP-5439主要透過 CYP3A4 代謝。Ripretinib和DP-5439排泄半衰期分別是14.8小時和17.8小時,口服清除率(oral clearance,CL/F)約為15.3L/hr和17.5L/hr。
二、臨床研究及安全性
發表於The Lancet Oncology期刊,名稱為INVICTUS10(NCT03353753)試驗是一項隨機、雙盲、國際性多中心、安慰劑對照臨床研究。旨在評估ripretinib四線治療晚期GIST患者與安慰劑相比的安全性、耐受性和有效性。共收納129名先前至少接受過3種(imatinib、sunitinib和regorafenib)療法的患者,以2:1的比例隨機分配到用藥組(ripretinib 150mg/天, 85位)或安慰劑組(44位)。
研究結果顯示:用藥組達到改善患者疾病無惡化存活期(Progression-free survival, PFS)為6.3個月,而安慰劑組僅為1.0個月(HR 0.15, 95% CI, 0.09-0.25; P<0.0001)。與安慰劑相比,用藥組降低了85%的PFS。具有臨床意義上的顯著改善。此外,6個月的PFS分別為51% (95% CI, 39.4至61.4) 和 3.2%(95% CI, 0.2至13.8)。 用藥組的整體存活(Overall survival, OS)為15.1個月,而安慰劑組為6.6個月(HR 0.36, 95% CI, 0.21至0.62)。顯示出具有臨床意義的OS獲益。此外,6個月的OS率為84.3%(95% CI, 74.5至90.6) 和55.9%(95% CI, 39.9至69.2),12個月的OS率為65.4%(95% CI, 51.6至76.14) 和25.9%(95% CI, 7.2至49.9)。 用藥組中患者的腫瘤客觀緩解率(Objective Response Rate, ORR)為9.4%,而安慰劑組為0%(p=0.0504),並無顯著的統計學意義。
三、不良反應與注意事項5,9,10
有關安全性方面,ripretinib在臨床試驗上常見的副作用(發生率≥20%)10有:脫髮(49%)、肌痛(27%)、噁心(25%)、疲勞(24%)、肢端紅腫症(Palmar plantar erythrodysesthesia,PPE,也稱手足症候群, 21%)和腹瀉(20%)。而≥10%的副作用有便秘(15%)、食慾下降(14%)、體重下降(15%)、血膽紅素升高(14%)、關節痛(12%)、肌肉痙攣(12%)。Ripretinib可能會對發育中的胎兒或新生嬰兒造成傷害,孕婦及哺乳期婦女慎用。謹慎使用強效CYP3A抑制劑,必要時,需要更密切監測患者的不良反應。避免與強CYP3A誘導劑同時使用。
肆、總結
胃腸道基質瘤仍以手術切除為主要的治療方法。對於手術無法完全切除或轉移性/晚期的GIST治療以酪氨酸激酶抑制劑(imatinib, sunitinib, regorafenib)為主。然而,現在GIST治療藥物正在蓬勃發展。對於PDGFRα外顯子18突變(包括D842V突變)的患者,可以選擇接受avapritinib作為一線治療。此外,對於使用imatinib、sunitinib和 regorafenib已無效果,疾病持續惡化的患者,可以選擇ripretinib作為第四線治療藥物。此兩種新型藥物(avapritinib, ripretinib)剛被核准用於治療晚期GIST患者,在療效獲益與安全性的臨床結果相當漂亮。Avapritinib (泰時維, Ayvakit)和Ripretinib (期樂錠, Qinlock)已經取得藥證引進臺灣市場,但目前尚未納入健保給付,有需要的患者需要自費使用。未來,希望都能納入健保體系用藥,讓更多的GIST患者能因此受惠,得以控制疾病及延長存活。
Novel Medications for the Treatment of Gastrointestinal Stromal Tumor
Ying-Tao Wu1, Chun-Nan Wu1, Chien-Ying Lee2
1Department of Pharmacy, Chung-Shan Medical
University Hospital
2Department of Pharmacology, Chung-Shan Medical
University
Abstract
Gastrointestinal stromal tumors (GIST), which is the most common mesenchymal tumor of the digestive tract, account for 1%-3% of gastrointestinal tumors. The median age at diagnosis is 66–69 years, with equal distribution of men and women. GIST originates from the interstitial cells of cajal (ICCs), and it can arise from any part of the gastrointestinal tract, most commonly in the stomach (60-70%), followed by the small bowel (20-30%). The first line of treatment for patients with localized GISTs is surgical resection. The treatment for metastatic or unresectable GISTs includes imatinib, sunitinib, and regorafenib. Recently, Food and Drug Administration(FDA) approved two new tyrosine kinase inhibitors for the treatment of heavily pretreated advanced/unresectable GIST including avapritinib (a selective inhibitor for PDGFRA exon 18 mutation including D842V mutations) and ripretinib (a broad-spectrum kinase inhibitor of c-Kit and PDGFRA). This review article summarizes the efficacy and safety data currently available for conventional TKIs along with recently approved and experimental therapies.
參考資料:
1. Al-Share B, Alloghbi A, Al Hallak MN, et al. Gastrointestinal stromal tumor: a review of current and emerging therapies. Cancer Metastasis Rev. 2021 Jun; 40(2):625-641.
2. Patel SR, Reichardt P. An updated review of the treatment landscape for advanced gastrointestinal stromal tumors. Cancer. 2021 Jul; 127(13):2187-2195.
3. 面對胃腸道基質瘤(第六版), 財團法人癌症希望基金會. 2021/5
4. Dhillon S. Avapritinib: First Approval. Drugs. 2020 Mar; 80(4):433-439.
5. IBM Micromedex® DRUGDEX®(electronic version).
6. Product Information:Ayvakit®
7. Alzofon N, Jimeno A. Avapritinib for metastatic or unresectable gastrointestinal stromal tumors. Drugs Today(Barc). 2020 Sep; 56(9):561-571.
8. Dhillon S. Ripretinib: First Approval. Drugs. 2020 Jul; 80(11):1133-1138.
9. Product Information:Qinlock®
10. Blay JY, Serrano C, Heinrich MC, et al. Ripretinib in patients with advanced gastrointestinal stromal tumours (INVICTUS): a double-blind, randomised, placebo-controlled, phase 3 trial. Lancet Oncol. 2020 Jul; 21(7):923-934.
通訊作者:李建瑩/通訊地址:台中市南區建國北路一段110號中山醫學大學附設醫院藥劑科
服務單位:中山醫學大學附設醫院/聯絡電話:(O) 04-24730022 ext 11664