使用Xeljanz XR之適當性評估
與用藥問題
江俐慧1、游佳玲1、蔡慈貞1,2、卓偉民3、方耀凡4
1林口長庚紀念醫院藥劑部、2新生醫護管理專科學校
3桃園長庚紀念醫院藥材管理部、4林口長庚風濕過敏免疫科
摘要
Extended-release tofacitinib(Xeljanz XR)是新型口服Janus激酶抑制劑tofacitinib的持續性藥效錠。衛生福利部核准的適應症有類風濕性關節炎、乾癬性關節炎及潰瘍性結腸炎。本研究旨在探討Xeljanz XR於北部某醫院多中心的藥物臨床使用,確保用藥之合理性及安全性。本研究在六個月期間(2020年10月21日至2021年4月20日)共收錄115例病人,類風濕性關節炎的病人有99位(86.1%);12位(10.4%)用於治療乾癬性關節炎。仿單核准適應症外使用(off-label use)的病人有4位:史蒂芬強森症候群 (n=3)及圓禿(n=1),但有醫學文獻佐證。安全性部分,以治療相關的不良事件來呈現。有五位病人出現治療相關的不良事件,包括頭痛、感染、肝指數上升及血球異常。評估結果Xeljanz XR於臨床的使用適當,且未發生嚴重藥物不良反應。
關鍵字: Tofacitinib、持續性藥效錠、藥物使用評估、類風濕關節炎、史蒂芬強森症候群、圓禿
壹、前言
Tofacitinib extended-release(XR)是新型口服Janus激酶(Janus kinase, JAK)抑制劑tofacitinib的持續性藥效錠。衛生福利部核准的適應症為治療類風濕性關節炎(rheumatoid arthritis, RA)、乾癬性關節炎(psoriatic arthritis, PsA)及潰瘍性結腸炎(ulcerative colitis, UC)。
JAK抑制劑是干擾JAKs活化的小分子藥物,而JAKs參與了細胞的生長、分化和凋零,其中,對免疫細胞和造血細胞影響更大1。Tofacitinib是JAK1、JAK3的小分子口服選擇性抑制劑,對JAK2、TYK2的抑制程度較小2。美國食品藥物管理局 (Food and Drug Administration, FDA) 於2012年及2016年通過短、長效的 tofacitinib 可使用於RA病人。依據文獻3指出減少藥物一天的使用次數,可以增加病人的遵醫囑性。可預期一天使用一次的Xeljanz XR,將會取代大部份 tofacitinib 5mg 膜衣錠短效劑型的使用。至今,有關Xeljanz XR國內外實證仍相當缺乏。本研究的目的在評估本院北院區多中心病人,實際使用Xeljanz XR的適應症、劑量及治療相關副作用。
貳、研究對象與方法
本研究有取得某醫學中心倫理審查委員會審核通過證明(案號:202101072B0)。採病歷回顧方式進行回溯性研究,透過本院建置的醫療資訊系統(Hospital Information System, HIS),蒐集2020年10月21日至2021年4月20日六個月期間至某醫院北部五院區就診且初次使用 Xeljanz XR的病人為研究樣本,後續追蹤至2021年12月31日,進行處方適當性及藥品安全性評估。
紀錄期間病人的基本資料,包括性別及首次使用的年齡。處方適當性則評估使用Xeljanz XR的適應症、劑量、併用藥物。安全性部份,針對停用Xeljanz XR的原因分析及紀錄後續更改的藥品。
參、結果
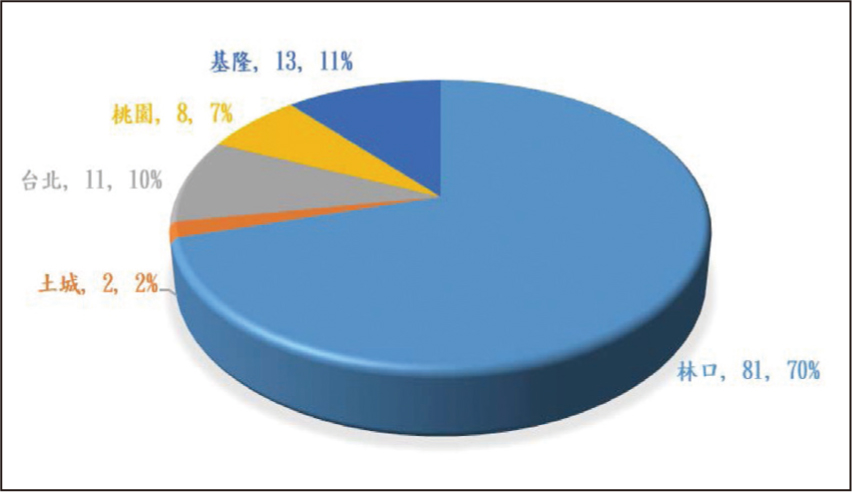
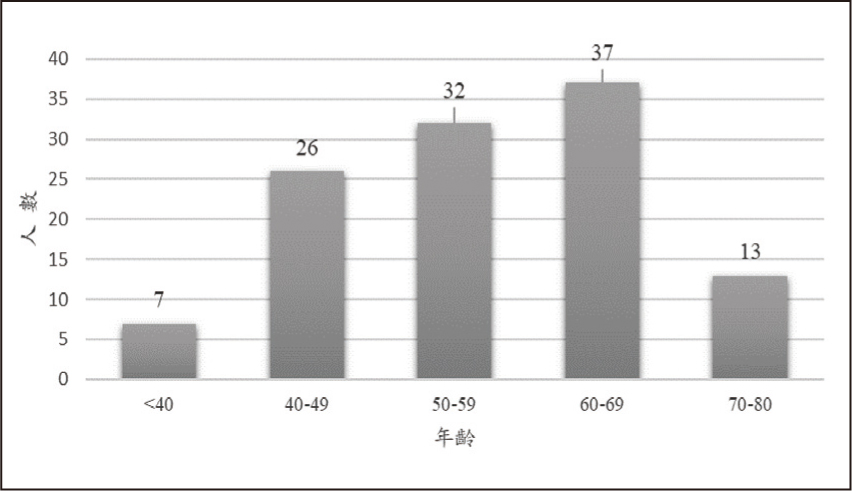
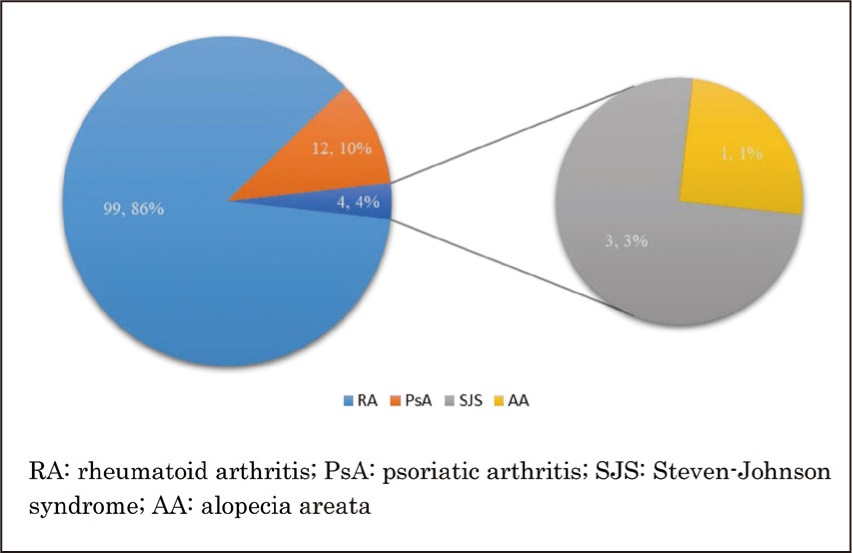
自2020年10月21日至2021年4月20日初次使用Xeljanz XR的病人有115位,主要分佈於林口院區(圖一)。研究對象中,女性占四分之三。大約二成(23.5%)的病人為65歲以上的老年人(圖二)。類風濕性關節炎的病人有99位(86.1%);12位(10.4%)的適應症為乾癬性關節炎。衛福部仿單核准適應症外使用(off-label use)共4位病人,其中,Xeljanz XR的處方均為自費開立。適應症為史蒂芬強森症候群(Steven-Johnson Syndrome)(n=3)及圓禿 (alopecia areata)(n=1)(圖三)。截至2021年12月31日止,除了史蒂芬強森症候群的病人短期(12-14天)早晚使用Xeljanz XR 11 mg,其他病人的使用劑量為每日一次,平均使用360天(24-435天)。
圖一 各院區病人數及百分比分佈
圖二 病人年齡分佈
圖三 使用Xeljanz XR的適應症分析
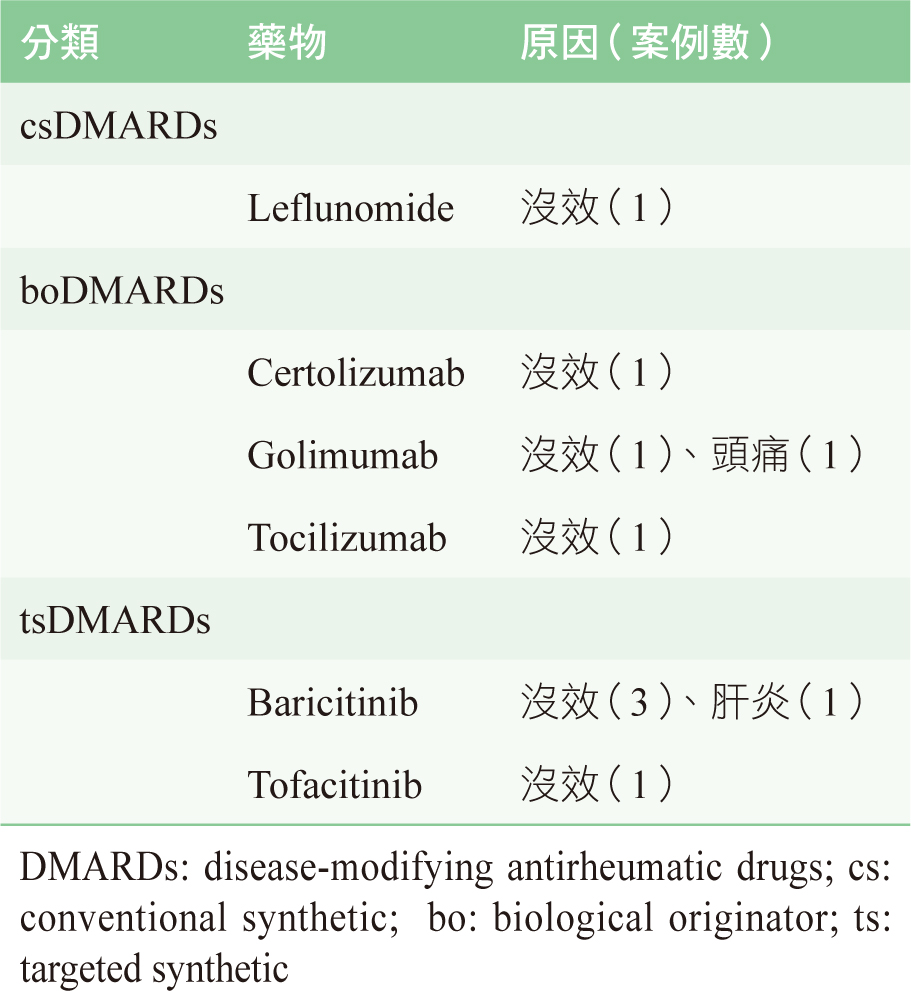
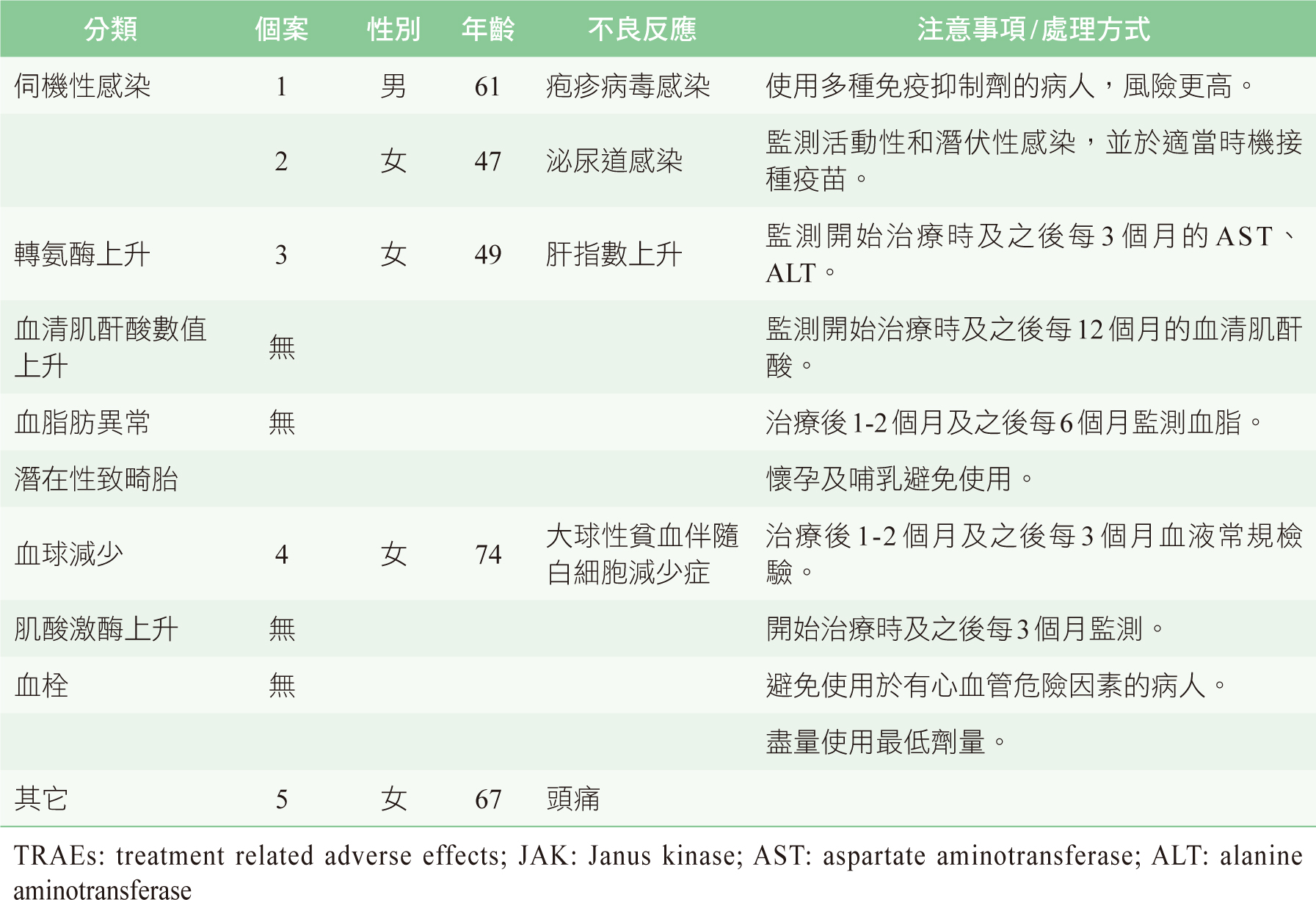
安全性部分,以治療相關的不良事件(treatment related adverse effects, TRAEs)來呈現。由於類風濕性關節炎病人,常會合併使用多種藥物的組合。主要為傳統疾病修飾抗風濕病藥物 (conventional synthetic disease-modifying antirheumatic drugs , csDMARDs),依序有methotrexate(72.5%)、prednisolone(50%)、hydroxychloroquine(42.2%)、sulfasalazine(23.5)及leflunomide(23.5%)。試驗期間,共有15名病人(13名女性、2名男性、平均年齡55.7歲)停止接受Xeljanz XR治療,平均使用111天(24-390天)。其中,9例病人因效果不佳而停用;5位出現TRAEs無法繼續使用;1位病人的病歷未註明停用原因。TRAEs有頭痛、肝指數上升、大球性貧血伴隨白細胞減少症、疱疹病毒及泌尿道感染各一位。15位病人中,5位直接停掉Xeljanz XR,10位病人的處方則改成:未使用過的csDMARDs(n=1)、4位改用生物製劑、4位改用另一種JAK抑制劑(Baricitinib),甚至有1位改回去之前所使用短效的tofacitinib(表一)。
表一 停用Xeljanz XR 後新增的藥物
肆、討論
這項研究回顧分析多中心115例初次使用Xeljanz XR的病人,以探討臨床實際的處方適當性及病人耐受性。
一、Xeljanz XR 製劑及藥動學的考量
對於需長期服用藥物的慢性病病人,Xeljanz XR每天一次的使用方式,增加了病人使用的便利性,可能會增加遵醫囑性3。為了能夠一天只需要使用一次的簡單用藥,Xeljanz XR製劑的開發,是採用可擠出核心系統的滲透傳輸技術。也就是說,Xeljanz XR不能打開、剝半和磨粉。藥物動力學部份,tofacitinib的口服生體可用率為74%;與食物併服對曲線下方的面積(area under curve, AUC)並無影響;70%由肝臟代謝;原型的30%由腎臟排除。若病人的肝臟或腎臟功能不全,須調整tofacitinib的劑量為原來的一半4。此時,則不適合使用Xeljanz XR,需改成短效的劑型。115例病人於試驗期間,肝、腎功能均正常,Xeljanz XR的使用劑量適當。
二、仿單標示適應症使用
(一) 類風濕關節炎
本試驗中,Xeljanz XR大部分用在RA的病人(86.1%)。RA是一種慢性自身免疫性疾病,其特徵在於關節發炎和破壞。它可能會導致病人關節功能受損、健康狀況下降和生活質量下降5。2019年歐洲抗風濕聯盟(European League Against Rheumatism, EULAR) 指出RA的主要治療目標是達到並維持緩解,即28個關節計數疾病活動評分(disease activity score by 28 joints, DAS28)小於2.6。或者如果不能達到,至少要降低疾病活動度至低度(low disease activity, LDA),即DAS28介於2.6和3.2之間6。
傳統合成性疾病修飾型抗風濕藥品(conventional synthetic disease-modifying antirheumatic drugs, csDMARDs),尤其是methotrexate(MTX)長期以來一直是RA治療的基礎藥物6。儘管後來生物製劑(biological disease-modifying antirheumatic drugs, bDMARDs)徹底改變了RA的治療方法,使用生物製劑的病人可能會隨著時間的流逝,會經歷不良事件或喪失有效性。一篇為期12年的觀察性研究,大約五分之一的RA病人對csDMARDs或bDMARDs未獲得滿足的治療,證實了對替代療法如tofacitinib等JAK抑制劑的需求7。
(二) 乾癬性關節炎
在多項隨機試驗中證明tofacitinib對PsA的治療有效,包括對csDMARD反應不足8和腫瘤壞死因子(Tumor necrosis factor, TNF)抑制劑治療反應不足的病人9。
已發表的主要試驗包括: 在一項隨機3期試驗(Oral Psoriatic Arthritis Trial [OPAL] Broaden)中,422名患有活動性PsA、對至少一種csDMARD反應不足且未接受過TNF抑制劑治療的病人,加入tofacitinib(5mg或10mg,每天兩次)或adalimumab(每兩周皮下注射40mg)。Tofacitinib組治療兩周比安慰組有更佳成效。三個月後的兩組的療效均優於安慰劑。追蹤至第12個月,藥效仍得以維持,兩種活性藥物的嚴重不良反應發生率相似8。
在另一項隨機3期試驗(OPAL Beyond)中,395名患有活動性PsA 且對TNF抑制劑反應不足的病人,在三個月時與安慰劑相比,以tofacitinib(5mg或10mg,每天兩次)治療後獲益更大。在為期六個月的試驗中仍有療效。不良反應與在RA或PsA的其他試驗中觀察到的結果相似9。
三、衛福部仿單核准適應症外使用 (off-label use)
依據行政院衛福部九十一年二月八日衛署醫字第0910014830號函,仿單核准適應症外(off-label use)之使用原則中,提及「需符合醫學原理及臨床藥理(合理使用)」。本院亦有公告醫學文獻佐證包含:衛生主管機關指引、學會指引、經實證醫學證明之文獻、教科書及科學引文索引(Scientific Citation Index,SCI)期刊。本試驗中有4位病人自費使用Xeljanz XR的適應症為off-lable use,闡述如下:
(一) 史蒂芬強森症候群
史蒂芬強森症候群的早期診斷和預後仍然是一個挑戰。Su等人證明了IL-15於血清中的濃度與史蒂芬強森症候群病人的預後之間存在關聯10。他們的發現為進一步研究提供了思路,並為可能的新療法提供線索。已知各種JAK複合物介導不同的細胞因子信號通路,對淋巴細胞增殖和體內平衡至關重要的JAK1-JAK3複合物,由如IL-15等白細胞介素誘導。一項體外試驗測試JAK抑制劑,包括baricitinib、decernotinib、filgotinib、ruxolitinib、tofacitinib,對IL-15的50%抑制濃度從55.8nM到2140nM。Tofacitinib (55.8nM)為同類中最低,表示抑制IL-15效果為最強11。Kim等人使用tofacitinib於原先的藥物組合,成功的治療一位cotrimoxazole誘發致命的嚴重藥物過敏反應12。
(二) 圓禿
圓禿是一種自身免疫性疾病,通過毛囊攻擊導致非瘢痕性脫髮。根據人種和研究領域的不同,罹病率可能從0.1%到6.9%不等。整體來說,根據嚴重程度和脫髮發生的區域,可以進一步分為三個不同的組:
(1) 斑塊狀圓禿,被認為是臨床上最常見的形式。 呈現圓形、橢圓形特徵的禿頭或身體出現不同部位的斑塊。
(2) 全禿,代表頭皮上頭髮的全部脫落。
(3) 普遍性脫髮,是3種中最嚴重的一種。除了面部和頭皮外,全身脫髮。
不幸的是,沒有治癒方法,也沒有普遍證明的治療方法可以誘導持續緩解圓禿。傳統醫學療法包括皮質類固醇、免疫療法和光療法,皮質類固醇似乎是最常見的治療方法。局部、病灶內或全身性皮質類固醇用於消除炎症、防止脫髮和控制症狀。研究顯示,使用皮質類固醇的頭髮再生率約為60%。然而,由於皮質類固醇的使用會產生副作用,例如體重增加、缺血性壞死、高血壓、糖尿病、睡眠障礙、情緒變化和痤瘡。除了不良反應外,患者對治療的反應率差異很大。許多因素可能會影響治療結果,例如年齡、家族史、疾病發作和其他可能相關的臨床狀況。因此,急需更有效、更安全的治療方案來治療。
越來越多的證據表明,通過抑制依賴JAK來轉導信號及激活轉錄(signal transducers and activators of transcription, STAT),tofacitinib可能對圓禿有潛在的治療作用。一篇2020年系統性文獻回顧及統合分析幾項臨床試驗的結果顯示,圓禿病人對tofacitinib治療有反應。然而,每項臨床試驗的樣本量都很小並且療效變化很大(0%–100%),且停藥後常出現疾病復發。在毒性方面,不良反應包括輕微症狀。 上呼吸道感染、頭痛和痤瘡是最常見的13。
三、治療相關的不良事件
由於JAK的不同組合和生長因子、激素和細胞因子受體有相關,使得它們的效果是多樣性的。依據文獻顯示,JAK抑制劑可能導致血液學、代謝或免疫抑制不良反應。可能發生之症狀分類與本篇觀察到之個案編號如表二14。鑑於JAK對造血的影響,應定期評估血液常規檢驗。據報導,肝轉氨酶、肌酐和肌酸磷酸激酶的血清水平可能會升高,但這些升高與肝或腎功能衰竭或橫紋肌溶解無關。還觀察到膽固醇濃度會隨劑量增加而上升,儘管這一發現與RA病人長達8.5年心血管事件發生率無關14。
表二 5位TRAEs分析與JAK抑制劑相關的不良反應14
排除4位off-label use,111位病人有5位於平均110天(51-139天)因發生TRAEs而停止使用Xeljanz XR,其發生率為4.5%。各有一位病人因頭痛、肝指數上升、血球異常、疱疹病毒及泌尿道感染,停用Xeljanz XR。一篇瑞士的研究收集2015年1月至2017年4月共144個病人(女性69.4%、平均年齡59.7歲),結果顯示導致停用tofacitinib的TRAEs中,最常見的是胃腸道AE,其次是感染15。本試驗中停藥最主要的原因則為感染,接受Xeljanz XR治療的病人無嚴重或危及生命的不良事件發生。
伍、結論
此次研究針對Xeljanz XR的藥品使用評估,主要使用於類風濕性關節炎及乾癬性關節炎的病人。期間病人的肝腎功能正常,使用Xeljanz XR 11mg每日一次的使用方式適當。衛福部仿單核准適應症外使用有史蒂芬強森症候群及圓禿,並有SCI期刊醫學文獻佐證。Xeljanz XR的安全性,總體上與以前的研究一致。我們的研究結果顯示 Xeljanz XR 於臨床使用適當,且未發生嚴重藥物相關的不良反應。
誌謝
謹此感謝長庚紀念醫院北院區藥師們的協助:林口院區黎佳琳藥師和陳兆俞藥師、基隆院區蔡雨駒藥師、台北及桃園院區林易萱藥師、土城院區廖若伶藥師。
Xeljanz XR Use Appropriateness Assessment and its Drug-related Problems
Li-Huei Chiang1, Chia-Ling Yu1,
Tzu-ChengTsai1,2, Wei-Min Cho3, Yao-Fan Fang4
1Department of Pharmacy, Chang Gung Memorial
Hospital, Linkou
2Department of Long Term Care, Hsin Sheng Junior
College of Medical Care and Management
3Department of Pharmaceutical Materials
Management, Chang-Gung Memorial Hospital,Taoyuan
4Division of Rheumatology, Allergy and
Immunology, Chang Gung Memorial Hospital, Linkou
Abstract
Xeljanz XR is an oral JAK inhibitor, the extended release formulation of tofacitinib. The indications approved by the Ministry of Health and Welfare include rheumatoid arthritis, psoriatic arthritis and ulcerative colitis. The purpose of this study aimed to investigate the clinical use of Xeljanz XR and to ensure its rationality and safety in a multi-center hospital located at the north Taiwan. A total of 115 patients were treated with Xeljanz XR. There are 99 rheumatoid arthritis patients (86.1%) ,12 psoriatic arthritis cases (10.4%) and 4 patients including Steven Johnson syndrome (n=3) and alopecia areata (n=1) use based on off-label indications supported by scientific evidence. The safety issues of Xeljanz XR is presented as treatment-related adverse events (TRAEs). Five patients suffered from TRAEs, which included headache, zoster, urinary tract infection, liver enzyme elevated, and macrocytic anemia with leukopenia. In conclusion, Xeljanz XR is appropriately used and no serious adverse drug events occurred.
參考資料:
1. Ghoreschi K, Laurence A, O'Shea JJ. Janus kinases in immune cell signaling. Immunological reviews. 2009;228(1):273-287.
2. Taylor PC. Clinical efficacy of launched JAK inhibitors in rheumatoid arthritis. Rheumatology (Oxford, England). 2019;58(Suppl 1):i17-i26.
3. Coleman CI, Limone B, Sobieraj DM, et al. Dosing frequency and medication adherence in chronic disease. Journal of managed care pharmacy : JMCP. 2012;18(7):527-539.
4. Cada DJ, Demaris K, Levien TL, Baker DE. Tofacitinib. Hospital pharmacy. 2013;48(5):413-424.
5. Heinimann K, von Kempis J, Sauter R, et al. Long-Term Increase of Radiographic Damage and Disability in Patients with RA in Relation to Disease Duration in the Era of Biologics. Results from the SCQM Cohort. Journal of clinical medicine. 2018;7(3).
6. Smolen JS, Landewé RBM, Bijlsma JWJ, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2019 update. Annals of the rheumatic diseases. 2020;79(6):685-699.
7. Kaltsonoudis E, Pelechas E, Voulgari PV, Drosos AA. Unmet needs in the treatment of rheumatoid arthritis. An observational study and a real-life experience from a single university center. Seminars in arthritis and rheumatism. 2019;48(4):597-602.
8. Mease P, Hall S, FitzGerald O, et al. Tofacitinib or Adalimumab versus Placebo for Psoriatic Arthritis. The New England journal of medicine. 2017;377(16):1537-1550.
9. Gladman D, Rigby W, Azevedo VF, et al. Tofacitinib for Psoriatic Arthritis in Patients with an Inadequate Response to TNF Inhibitors. The New England journal of medicine. 2017;377(16):1525-1536.
10. Su SC, Mockenhaupt M, Wolkenstein P, et al. Interleukin-15 Is Associated with Severity and Mortality in Stevens-Johnson Syndrome/Toxic Epidermal Necrolysis. The Journal of investigative dermatology. 2017;137(5):1065-1073.
11. Winthrop KL. The emerging safety profile of JAK inhibitors in rheumatic disease. Nature reviews Rheumatology. 2017;13(4):234-243.
12. Kim D, Kobayashi T, Voisin B, et al. Targeted therapy guided by single-cell transcriptomic analysis in drug-induced hypersensitivity syndrome: a case report. Nature medicine. 2020;26(2):236-243.
13. Guo L, Feng S, Sun B, Jiang X, Liu Y. Benefit and risk profile of tofacitinib for the treatment of alopecia areata: a systemic review and meta-analysis. Journal of the European Academy of Dermatology and Venereology : JEADV. 2020;34(1):192-201.
14. Salas A, Hernandez-Rocha C, Duijvestein M, et al. JAK-STAT pathway targeting for the treatment of inflammatory bowel disease. Nature reviews Gastroenterology & hepatology. 2020;17(6):323-337.
15. Mueller RB, Hasler C, Popp F, et al. Effectiveness, Tolerability, and Safety of Tofacitinib in Rheumatoid Arthritis: A Retrospective Analysis of Real-World Data from the St. Gallen and Aarau Cohorts. Journal of clinical medicine. 2019;8(10).
通訊作者:方耀凡/通訊地址:桃園市龜山區復興街五號
服務單位:林口長庚風濕過敏免疫科醫師/聯絡電話:(O) 0975366094